Поражение почек при системной красной волчанке и системных васкулитах у детей и подростков А. Н. Цыгин, НЦЗД РАМН Москва
 Американская ревматологическая ассоциация. Критерии СКВ (1992) Сыпь в виде «бабочки» Дискоидная эритема Фоточувствительность Стоматит Артриты Серозиты (плеврит, перикардит) Протеинурия > 0. 5 г/сут или эритроцитарные цилиндры Судороги или психоз Гемолитическая анемия, лейкопения
Американская ревматологическая ассоциация. Критерии СКВ (1992) Сыпь в виде «бабочки» Дискоидная эритема Фоточувствительность Стоматит Артриты Серозиты (плеврит, перикардит) Протеинурия > 0. 5 г/сут или эритроцитарные цилиндры Судороги или психоз Гемолитическая анемия, лейкопения
 Базовая серологическая диагностика СКВ Антитела к двуспиральной ДНК Антинуклеарный фактор Низкий С 3 Низкий С 4 Дополнительные: Анти-RO, Анти-SA, Анти. Hep-2 и др.
Базовая серологическая диагностика СКВ Антитела к двуспиральной ДНК Антинуклеарный фактор Низкий С 3 Низкий С 4 Дополнительные: Анти-RO, Анти-SA, Анти. Hep-2 и др.
 Эпидемиология СКВ у детей Встречаемость F 0. 2 - 0. 4 случая в год на 100, 000 детей
Эпидемиология СКВ у детей Встречаемость F 0. 2 - 0. 4 случая в год на 100, 000 детей
 American College of Rheumatology пересмотр критериев классификации СКВ: поражение почек Нефрит u. Персистирующая протеинурия – > 0. 5 г в день или – > 3+ по тест-полоске при отсутствии количественного метода Или u. Клеточные цилиндры – Эритроцитарные, зернистые, канальцевые, гемоглобуновые или смешанные
American College of Rheumatology пересмотр критериев классификации СКВ: поражение почек Нефрит u. Персистирующая протеинурия – > 0. 5 г в день или – > 3+ по тест-полоске при отсутствии количественного метода Или u. Клеточные цилиндры – Эритроцитарные, зернистые, канальцевые, гемоглобуновые или смешанные
 Частота симптомов при ювенильном и взрослом дебюте СКВ Почечные симптомы Ювенильное начало Взрослое начало (%) p Протеинурия 63. 6 43. 2 ≤ 0. 01 Гломерулонефрит Клет. цилиндры в моче 62. 5 36 ≤ 0. 001 57. 1 32 ≤ 0. 001 Juvenile-onset systemic lupus erythematosus: different clinical and serological pattern than adult-onset systemic lupus erythematosus I E A Hoffman, B R Lauwerys, F De Keyser, et al. Ann Rheum Dis 2009.
Частота симптомов при ювенильном и взрослом дебюте СКВ Почечные симптомы Ювенильное начало Взрослое начало (%) p Протеинурия 63. 6 43. 2 ≤ 0. 01 Гломерулонефрит Клет. цилиндры в моче 62. 5 36 ≤ 0. 001 57. 1 32 ≤ 0. 001 Juvenile-onset systemic lupus erythematosus: different clinical and serological pattern than adult-onset systemic lupus erythematosus I E A Hoffman, B R Lauwerys, F De Keyser, et al. Ann Rheum Dis 2009.
 ISN/RPS классификация волчаночного нефрита (2003) Минимальный мезангиальный ВН Мезангиальный пролиферативный ВН Фокальный ВН Диффузный сегментарный (IV-S) или глобальный (IV-G) ВН. Класс V Мембранозный ВН Класс VI Распространенный склерозирующий ВН Класс III Класс IV
ISN/RPS классификация волчаночного нефрита (2003) Минимальный мезангиальный ВН Мезангиальный пролиферативный ВН Фокальный ВН Диффузный сегментарный (IV-S) или глобальный (IV-G) ВН. Класс V Мембранозный ВН Класс VI Распространенный склерозирующий ВН Класс III Класс IV

 Класс I и II Мезангиальные изменения Нормальные гломерулы или увеличение мезангиального матрикса и клеток Депозиты на ИФ и ЭМ Normal glomerulus
Класс I и II Мезангиальные изменения Нормальные гломерулы или увеличение мезангиального матрикса и клеток Депозиты на ИФ и ЭМ Normal glomerulus
 Класс III и IV Фокальный или диффузный ГН Эндокапиллярная пролиферация u «проволочные петли» u Суб-эндотелиальные депозиты u Сужение просветов капилляров Экстракапиллярная пролиферация u ‘Полулуния’ «Клинический нефрит»
Класс III и IV Фокальный или диффузный ГН Эндокапиллярная пролиферация u «проволочные петли» u Суб-эндотелиальные депозиты u Сужение просветов капилляров Экстракапиллярная пролиферация u ‘Полулуния’ «Клинический нефрит»
 Класс V Мембранозный u «Шипики «(‘spikes’) u. Массивные субэпителиальные депозиты на ЭМ и ИФ Нефрит/нефротический синдром
Класс V Мембранозный u «Шипики «(‘spikes’) u. Массивные субэпителиальные депозиты на ЭМ и ИФ Нефрит/нефротический синдром

 Прогноз при IV классе ВН Наихудший прогноз без лечения u 17% пятилетней выживаемости в 1953 -1969 С лечением - лучше u 82% в начале 1990 -х » Flanc RS et al. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews 2004
Прогноз при IV классе ВН Наихудший прогноз без лечения u 17% пятилетней выживаемости в 1953 -1969 С лечением - лучше u 82% в начале 1990 -х » Flanc RS et al. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews 2004
 Почечное поражение увеличивает смертность Почечное повреждение – наиболее важный предиктор смертности при СКВ Danila et al. Rheumatology 2009 Кривые выживаемости: верхняя – без почечного повреждения, нижняя – с почечным повреждением
Почечное поражение увеличивает смертность Почечное повреждение – наиболее важный предиктор смертности при СКВ Danila et al. Rheumatology 2009 Кривые выживаемости: верхняя – без почечного повреждения, нижняя – с почечным повреждением
 Цели лечения волчаночного нефрита Индукция ремиссии Поддержание ремиссии FМинимизация побочных эффектовeffects – – – Инфекции Herpes zoster Инфертильность Костномозговая токсичность Хим. цистит Злокачественные заболевания
Цели лечения волчаночного нефрита Индукция ремиссии Поддержание ремиссии FМинимизация побочных эффектовeffects – – – Инфекции Herpes zoster Инфертильность Костномозговая токсичность Хим. цистит Злокачественные заболевания
 Препараты для лечения волчаночного нефрита Стероиды Циклофосфамид Азатиоприн ММФ Циклоспорин А Биологические агенты (ритуксимаб)
Препараты для лечения волчаночного нефрита Стероиды Циклофосфамид Азатиоприн ММФ Циклоспорин А Биологические агенты (ритуксимаб)
 Cochrane Database Systematic Review - 2004. Лечение люпус-нефрита Высокие и низкие дозы ЦФ Внутривенный и пероральный ЦФ Длительная и короткая терапия ЦФ u. Нет различий в исходах u. Нет различий в побочных эффектах
Cochrane Database Systematic Review - 2004. Лечение люпус-нефрита Высокие и низкие дозы ЦФ Внутривенный и пероральный ЦФ Длительная и короткая терапия ЦФ u. Нет различий в исходах u. Нет различий в побочных эффектах
 Cochrane Database Systematic Review - 2004. Лечение волчаночного нефрита. Заключение экспертов: FЦиклофосфамид и стероиды являются лучшим средством для сохранения почечных функций при пролиферативном ВН. FЖелательно минимизировать дозы и длительность лечения без снижения эффективности для предотвращения гонадотоксичности.
Cochrane Database Systematic Review - 2004. Лечение волчаночного нефрита. Заключение экспертов: FЦиклофосфамид и стероиды являются лучшим средством для сохранения почечных функций при пролиферативном ВН. FЖелательно минимизировать дозы и длительность лечения без снижения эффективности для предотвращения гонадотоксичности.
 Азатиоприн v. Циклофосфамида как терапия индукции. Dutch Working Party on Systemic Lupus Erythematosus. KI 2006 A. Больные с удвоением креатинина Aza > CYC B. Отсутствие рецидивов CYC > Aza C. Отсутствие неэффективности лечения, рецидива и смерти CYC > Aza
Азатиоприн v. Циклофосфамида как терапия индукции. Dutch Working Party on Systemic Lupus Erythematosus. KI 2006 A. Больные с удвоением креатинина Aza > CYC B. Отсутствие рецидивов CYC > Aza C. Отсутствие неэффективности лечения, рецидива и смерти CYC > Aza
 Лечение волчаночного нефрита Contreras et al. NEJM, 2004 Индукция в/в ЦФ Поддерживающее лечение в/в ЦФ v. Aza v. MMF Выживаемость без ХПН ч-з 72 мес u MMF & Aza > Cy. P Выживаемость без рецидивов u MMF > Cy. P Побочные эффекты (частота госпитализаций) u MMF & Aza
Лечение волчаночного нефрита Contreras et al. NEJM, 2004 Индукция в/в ЦФ Поддерживающее лечение в/в ЦФ v. Aza v. MMF Выживаемость без ХПН ч-з 72 мес u MMF & Aza > Cy. P Выживаемость без рецидивов u MMF > Cy. P Побочные эффекты (частота госпитализаций) u MMF & Aza
 The 10 -year follow-up data of the Euro. Lupus Nephritis Trial comparing low-dose and high-dose IV cyclophosphamide. Ann Rheum Diseases 2010 Kaplan–Meier analysis probability of (A) An absence of death – no difference (B) End-stage renal disease (ESRD) – no difference. (C) Sustained doubling of serum creatinine (SDSC) – no difference Houssiau F A et al. Ann Rheum Dis 2010; 69: 61 -64 © 2009 by BMJ Publishing Group Ltd and European League Against Rheumatism
The 10 -year follow-up data of the Euro. Lupus Nephritis Trial comparing low-dose and high-dose IV cyclophosphamide. Ann Rheum Diseases 2010 Kaplan–Meier analysis probability of (A) An absence of death – no difference (B) End-stage renal disease (ESRD) – no difference. (C) Sustained doubling of serum creatinine (SDSC) – no difference Houssiau F A et al. Ann Rheum Dis 2010; 69: 61 -64 © 2009 by BMJ Publishing Group Ltd and European League Against Rheumatism
 10 - летнее исследование Nephritis Trial Динамика протеинурии у больных с хорошим и плохим почечным исходом. Houssiau F A et al. Ann Rheum Dis 2010; 69: 61 -64 © 2009 by BMJ Publishing Group Ltd and European League Against Rheumatism
10 - летнее исследование Nephritis Trial Динамика протеинурии у больных с хорошим и плохим почечным исходом. Houssiau F A et al. Ann Rheum Dis 2010; 69: 61 -64 © 2009 by BMJ Publishing Group Ltd and European League Against Rheumatism
 Индукционная терапия ММФ приволчаночном нефрите. Метаанализ. Moore et al. CJASN, 2007. 4 исследования - 268 больных с ВН – Достоверное снижение риска провала лечения ММФ по сравнению с ЦФ. – Риск смерти или т. ХПН может быть ниже при ММФ чем при ЦФ – Нет доказательств повышенного риска побочных эффектов при использовании ММФ. Relative risk (RR) for treatment failure for lupus nephritis treated with MMF compared with CYC (RCT). RR for death or ESRD for lupus nephritis treated with MMF compared with CYC using extended follow-up data (RCT).
Индукционная терапия ММФ приволчаночном нефрите. Метаанализ. Moore et al. CJASN, 2007. 4 исследования - 268 больных с ВН – Достоверное снижение риска провала лечения ММФ по сравнению с ЦФ. – Риск смерти или т. ХПН может быть ниже при ММФ чем при ЦФ – Нет доказательств повышенного риска побочных эффектов при использовании ММФ. Relative risk (RR) for treatment failure for lupus nephritis treated with MMF compared with CYC (RCT). RR for death or ESRD for lupus nephritis treated with MMF compared with CYC using extended follow-up data (RCT).
 Исследование индукционной терапии ММФ vs в/в ЦФ Aspreva Lupus Management Study (ALMS) Международный двухфазовый рандомизированный контролитуемый трайл (индукция и поддержка). Нет достоверных различий эффективности – MMF 104/185 (56. 2%) v. IVCYC 98/185 (53. 0%) – У больных высокого риска, не белых, не азиатов ответ лучше на ММФ, чем на в/в ЦФ. Нет достоверных различий в частоте побочных эффектов и инфекций. Appel G B et al. JASN 2009; 20: 1103 -1112
Исследование индукционной терапии ММФ vs в/в ЦФ Aspreva Lupus Management Study (ALMS) Международный двухфазовый рандомизированный контролитуемый трайл (индукция и поддержка). Нет достоверных различий эффективности – MMF 104/185 (56. 2%) v. IVCYC 98/185 (53. 0%) – У больных высокого риска, не белых, не азиатов ответ лучше на ММФ, чем на в/в ЦФ. Нет достоверных различий в частоте побочных эффектов и инфекций. Appel G B et al. JASN 2009; 20: 1103 -1112
 ММФ при лечении детей и подростков с СКВ. Kazyra et al. Arch Dis Child 2010 ММФ у 26 детей и подростков F 14 – индукционная и поддерживающая терапия ММФ (A) F 12 – перевод на ММФ с Аза (B) 18/26 больных ВН подтвержден биопсией F Снижение альбуминурии и улучшение почечных функций в обеих группах
ММФ при лечении детей и подростков с СКВ. Kazyra et al. Arch Dis Child 2010 ММФ у 26 детей и подростков F 14 – индукционная и поддерживающая терапия ММФ (A) F 12 – перевод на ММФ с Аза (B) 18/26 больных ВН подтвержден биопсией F Снижение альбуминурии и улучшение почечных функций в обеих группах
 Ритуксимаб при системной красной волчанке. Системный обзор 188 случаев. Ramos-Casals et al. Lupus, 2009 188 случаев опубликовано 103/188 с ВН Различные режимы применения Ритуксимаба Общая частота ответа на лечение 91%.
Ритуксимаб при системной красной волчанке. Системный обзор 188 случаев. Ramos-Casals et al. Lupus, 2009 188 случаев опубликовано 103/188 с ВН Различные режимы применения Ритуксимаба Общая частота ответа на лечение 91%.
 Анти-B клеточная терапия у 19 больных с рефрактерной ювенильной СКВ. Podolskaya A et al. Arch Dis Child 2008 9 (48%) сниж. СКФ F 54 ml/min/1. 73 m 2, 13 (68%) повышение альб/креат мочи F Среднее - 254 mg/mmol После ритуксимаба Улучшение СКФ F 68 ml/min/1. 73 m 2 (p=0. 07) снижение альб/креат мочи F Чрез 3 и 18 мес (p=0. 002 и 0. 014)
Анти-B клеточная терапия у 19 больных с рефрактерной ювенильной СКВ. Podolskaya A et al. Arch Dis Child 2008 9 (48%) сниж. СКФ F 54 ml/min/1. 73 m 2, 13 (68%) повышение альб/креат мочи F Среднее - 254 mg/mmol После ритуксимаба Улучшение СКФ F 68 ml/min/1. 73 m 2 (p=0. 07) снижение альб/креат мочи F Чрез 3 и 18 мес (p=0. 002 и 0. 014)
 Ритуксимаб эффективен при ВН и позволяет снизить дозу стероидов. Ruth Pepper et al. NDT 2009. Больные с III/IV/V l классами ВН. Получали стероиды до развития ВН. 18 больных > 1 года наблюдения 14/18 (78%,) – полная или частичная ремиссия 12/18 (67%) сохранение ответа через 1 год 6 б-ных отмена преднизолона 6 – снижение дозы 6 – на той же дозе (
Ритуксимаб эффективен при ВН и позволяет снизить дозу стероидов. Ruth Pepper et al. NDT 2009. Больные с III/IV/V l классами ВН. Получали стероиды до развития ВН. 18 больных > 1 года наблюдения 14/18 (78%,) – полная или частичная ремиссия 12/18 (67%) сохранение ответа через 1 год 6 б-ных отмена преднизолона 6 – снижение дозы 6 – на той же дозе (
 Исследование LUNAR Randomized, placebo-controlled LUpus Nephritis Assessment with Rituximab (LUNAR) trial – Эффективность в отношении нефрита: RTX 57% v. placebo 45. 9% » American Society of Nephrology (ASN) 2009.
Исследование LUNAR Randomized, placebo-controlled LUpus Nephritis Assessment with Rituximab (LUNAR) trial – Эффективность в отношении нефрита: RTX 57% v. placebo 45. 9% » American Society of Nephrology (ASN) 2009.
 Ингибиторы АПФ при СКВ Кривая выживаемости Kaplan–Meier развития почечного повреждения и функции и. АПФ. Durán-Barragán S et al. Rheumatology 2008; 47: 1093 -1096
Ингибиторы АПФ при СКВ Кривая выживаемости Kaplan–Meier развития почечного повреждения и функции и. АПФ. Durán-Barragán S et al. Rheumatology 2008; 47: 1093 -1096


 Классификация васкулитов Крупные сосуды: Гигантоклеточный васкулит Аортоартериит Takayasu Средние сосуды: Узелковый полиартериит Ассоциированный с вирусом гепатита В FMF Кожный узелковый полиартериит Болезнь Kawasaki Средние и мелкие сосуды: Грануломатоз Wegener Синдром Churg-Strauss Микроскопический полиангиит (полиартериит) Васкулиты при заболеваниях соединительной ткани Синдром Behcet Мелкие сосуды: Пурпура Henoch-Schoenlein Криоглобулинемический васкулит
Классификация васкулитов Крупные сосуды: Гигантоклеточный васкулит Аортоартериит Takayasu Средние сосуды: Узелковый полиартериит Ассоциированный с вирусом гепатита В FMF Кожный узелковый полиартериит Болезнь Kawasaki Средние и мелкие сосуды: Грануломатоз Wegener Синдром Churg-Strauss Микроскопический полиангиит (полиартериит) Васкулиты при заболеваниях соединительной ткани Синдром Behcet Мелкие сосуды: Пурпура Henoch-Schoenlein Криоглобулинемический васкулит

 Патогенез васкулитов Васкулиты, ассоциированные с иммунными комплексами Пурпура Henoch-Schoenlein Васкулит при SLE и RA Васкулиты, ассоциированные с орган-специфическими антителами Синдром Goodpusture Болезнь Kawasaki Васкулиты, ассоциированные с ANCA Грануломатоз Wegener Микроскопический полиангиит Синдром Churg-Strauss Узелковый периартериит Лекарственные васкулиты Клеточно-опосредованные Болезнь Takayasu Грануломатоз Wegener
Патогенез васкулитов Васкулиты, ассоциированные с иммунными комплексами Пурпура Henoch-Schoenlein Васкулит при SLE и RA Васкулиты, ассоциированные с орган-специфическими антителами Синдром Goodpusture Болезнь Kawasaki Васкулиты, ассоциированные с ANCA Грануломатоз Wegener Микроскопический полиангиит Синдром Churg-Strauss Узелковый периартериит Лекарственные васкулиты Клеточно-опосредованные Болезнь Takayasu Грануломатоз Wegener

 Пурпура Henoch-Schoenlein Анафилактоидная пурпура. Мультисистемный васкулит микрососудов, проявляющийся поражением кожи, суставов, ЖКТ, почек. Наиболее часто встречающийся среди детей васкулит (частота примерно 14 на 100. 000 детей). Пик встречаемости приходится на детей 4 -5 лет, болеют чаще мальчики. Сезонное повышение заболеваемости приходится на зиму и раннюю весну. Васкулит с благоприятным исходом в подавляющем большинстве случаев не требует лечения (?).
Пурпура Henoch-Schoenlein Анафилактоидная пурпура. Мультисистемный васкулит микрососудов, проявляющийся поражением кожи, суставов, ЖКТ, почек. Наиболее часто встречающийся среди детей васкулит (частота примерно 14 на 100. 000 детей). Пик встречаемости приходится на детей 4 -5 лет, болеют чаще мальчики. Сезонное повышение заболеваемости приходится на зиму и раннюю весну. Васкулит с благоприятным исходом в подавляющем большинстве случаев не требует лечения (?).
 Механизм развития HSP Отложение Ig. A-содержащих иммунных комплексов в стенках мелких сосудов с развитием лейкоцитокластного васкулита. Отложение C 3 Больше поражаются посткапиллярные венулы Патогенез артралгий не известен Абдоминальный синдром- васкулит мезентериальных сосудов и некрозы кишечной стенки Поражение почек – депозиция Ig. A в мезангиуме. Отложение Ig. G может привести к образованию полулуний
Механизм развития HSP Отложение Ig. A-содержащих иммунных комплексов в стенках мелких сосудов с развитием лейкоцитокластного васкулита. Отложение C 3 Больше поражаются посткапиллярные венулы Патогенез артралгий не известен Абдоминальный синдром- васкулит мезентериальных сосудов и некрозы кишечной стенки Поражение почек – депозиция Ig. A в мезангиуме. Отложение Ig. G может привести к образованию полулуний
 HSP – клиническая картина У всех пациентов отмечаются симметричные высыпания на разгибательных поверхностях. В 1/3 случаев проявления преимущественно локализуются между коленным суставом и лодыжкой. Абдоминальный синдром наблюдается в 75% случаев (от легкой колики до инвагинации и перфорации). Вовлечение ЦНС – от головной боли до комы. У мужчин может появляться припухлость яичек. Поражение легких – в виде легочных кровотечений.
HSP – клиническая картина У всех пациентов отмечаются симметричные высыпания на разгибательных поверхностях. В 1/3 случаев проявления преимущественно локализуются между коленным суставом и лодыжкой. Абдоминальный синдром наблюдается в 75% случаев (от легкой колики до инвагинации и перфорации). Вовлечение ЦНС – от головной боли до комы. У мужчин может появляться припухлость яичек. Поражение легких – в виде легочных кровотечений.


 HSP – длительность сохранения симптомов У ⅓ пациентов симптомы сохраняются менее 14 дней. У ⅓ - в течение 2 – 4 недель. У ⅓ - более 4 недель. Рецидивы возникают примерно в 1/3 случаев в течение 4 месяцев. Рецидивы возникают чаще у пациентов с поражением почек.
HSP – длительность сохранения симптомов У ⅓ пациентов симптомы сохраняются менее 14 дней. У ⅓ - в течение 2 – 4 недель. У ⅓ - более 4 недель. Рецидивы возникают примерно в 1/3 случаев в течение 4 месяцев. Рецидивы возникают чаще у пациентов с поражением почек.
 HSP – нефрит Частота при HSP варьирует (20 -61%). Поражение почек может произойти через 2 месяца или позже от начала заболевания. Поражение почек может проявляться: a) b) c) d) Изолированной гематурией Протеинурией с гематурией Острым нефритическим синдромом Смешанным нефритически-нефротическим синдромом e) Нефротическим синдромом f) Острой почечной недостаточностью
HSP – нефрит Частота при HSP варьирует (20 -61%). Поражение почек может произойти через 2 месяца или позже от начала заболевания. Поражение почек может проявляться: a) b) c) d) Изолированной гематурией Протеинурией с гематурией Острым нефритическим синдромом Смешанным нефритически-нефротическим синдромом e) Нефротическим синдромом f) Острой почечной недостаточностью
 HSP нефрит - патология ISKDC Гистологическая классификация I Минимальные изменения II Мезангиальная пролиферация IIIa Фокальная пролиферация или склероз, менее 50% полулуний IIIb Диффузная пролиферация или склероз, менее 50% полулуний IVa Фокальная мезангиальная пролиферация или склероз, 50 -75% полулуний IVb Диффузная мезангиальная пролиферация или склероз, 50 -75% полулуний Va Фокальная мезангиальная пролиферация или склероз, более 75% полулуний Vb Диффузная мезангиальная пролиферация или склероз, более 75% полулуний VI Мембранопролиферативно-подобные изменения
HSP нефрит - патология ISKDC Гистологическая классификация I Минимальные изменения II Мезангиальная пролиферация IIIa Фокальная пролиферация или склероз, менее 50% полулуний IIIb Диффузная пролиферация или склероз, менее 50% полулуний IVa Фокальная мезангиальная пролиферация или склероз, 50 -75% полулуний IVb Диффузная мезангиальная пролиферация или склероз, 50 -75% полулуний Va Фокальная мезангиальная пролиферация или склероз, более 75% полулуний Vb Диффузная мезангиальная пролиферация или склероз, более 75% полулуний VI Мембранопролиферативно-подобные изменения
 HSP - лечение Большинство случаев HSP лёгкой степени тяжести и подлежат симптоматическому лечению. Тяжёлые симптомы со стороны ЖКТ (особенно боль в животе, кровотечения из ЖКТ), поражение яичек и лёгочные кровотечения лечатся кортикостероидами. Преднизон не предотвращает поражения почек
HSP - лечение Большинство случаев HSP лёгкой степени тяжести и подлежат симптоматическому лечению. Тяжёлые симптомы со стороны ЖКТ (особенно боль в животе, кровотечения из ЖКТ), поражение яичек и лёгочные кровотечения лечатся кортикостероидами. Преднизон не предотвращает поражения почек
 HSP- поддерживающая терапия Антитромбоцитарные препараты – дипиридамол 4 -5 мг/кг Гепарин (?) 200 ед/кг п/к или в/в Нестероидные противовоспалительные препараты Антибиотики только при наличии инфекции
HSP- поддерживающая терапия Антитромбоцитарные препараты – дипиридамол 4 -5 мг/кг Гепарин (?) 200 ед/кг п/к или в/в Нестероидные противовоспалительные препараты Антибиотики только при наличии инфекции
 HSP нефрит – лечение Рандомизированных исследований относительно применения иммуносупрессоров нет. Неконтролированные исследования показывают улучшение на фоне лечения преднизолоном и азатиоприном, циклофосфамидом, хлорамбуцилом, антикоагулянтами и антитромбоцитарными препаратами. Нефрит с полулуниями требует более агрессивного лечения: метилпреднизолон внутривенно, переливание плазмы и/или циклофосфамид. Среднетяжелый нефрит с полулуниями,
HSP нефрит – лечение Рандомизированных исследований относительно применения иммуносупрессоров нет. Неконтролированные исследования показывают улучшение на фоне лечения преднизолоном и азатиоприном, циклофосфамидом, хлорамбуцилом, антикоагулянтами и антитромбоцитарными препаратами. Нефрит с полулуниями требует более агрессивного лечения: метилпреднизолон внутривенно, переливание плазмы и/или циклофосфамид. Среднетяжелый нефрит с полулуниями,
 Лечение HSP-нефрита При изолированной гематурии лечение не проводится При нефротическом/нефритическом синдроме: В/в Метилпреднизолон 20 мг/кг (3 -6 инфузий) В/в Циклофосфамид 1 г/м 2 каждый месяц (6 месяцев) Преднизолон внутрь 1 -2 мг/кг через день Прогноз определяется количеством полулуний в биоптате
Лечение HSP-нефрита При изолированной гематурии лечение не проводится При нефротическом/нефритическом синдроме: В/в Метилпреднизолон 20 мг/кг (3 -6 инфузий) В/в Циклофосфамид 1 г/м 2 каждый месяц (6 месяцев) Преднизолон внутрь 1 -2 мг/кг через день Прогноз определяется количеством полулуний в биоптате
 Болезнь Kawasaki Слизисто-кожно-лимфатический васкулит Частота варьирует (США до 4300 случаев в год) Одна из основных причин приобретенных болезней сердца у детей Чаще – у детей до 5 лет (в среднем – 2 года), чаще у мальчиков Этиология не известнаю Патогенез – участие антиэндотелиальных антител
Болезнь Kawasaki Слизисто-кожно-лимфатический васкулит Частота варьирует (США до 4300 случаев в год) Одна из основных причин приобретенных болезней сердца у детей Чаще – у детей до 5 лет (в среднем – 2 года), чаще у мальчиков Этиология не известнаю Патогенез – участие антиэндотелиальных антител
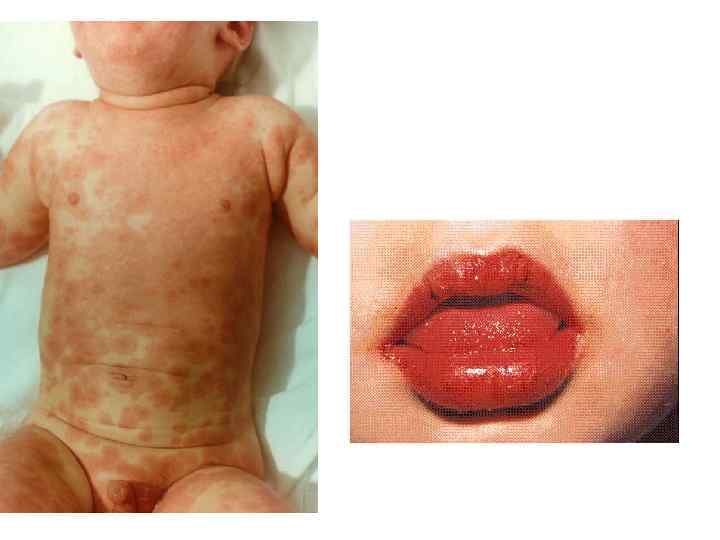
 Болезнь Kawasaki-симптомы Лихорадка от 5 дней до 3 -4 недель Увеличение шейных лимфатических узлов Кожные высыпания на туловище и животе Конъюнктивит Отечный, малиновый язык Сухие, красные, потрескавшиеся губы Красные отечные ладони и подошвы Шелушение кожи около ногтей, на ладонях и стопах Тромбоцитоз (>450. 000), лейкоцитоз Аневризмы коронарных артерий (у 20%)
Болезнь Kawasaki-симптомы Лихорадка от 5 дней до 3 -4 недель Увеличение шейных лимфатических узлов Кожные высыпания на туловище и животе Конъюнктивит Отечный, малиновый язык Сухие, красные, потрескавшиеся губы Красные отечные ладони и подошвы Шелушение кожи около ногтей, на ладонях и стопах Тромбоцитоз (>450. 000), лейкоцитоз Аневризмы коронарных артерий (у 20%)


 Кардиоваскулярный проявления ЭКГ – Аритмия – Измененный QT – Расширение PR и/или QT – Снижение вольтажа – Изменения ST-T Кардиомегалия
Кардиоваскулярный проявления ЭКГ – Аритмия – Измененный QT – Расширение PR и/или QT – Снижение вольтажа – Изменения ST-T Кардиомегалия

 Болезнь Kawasaki - лечение Внутривенное введение Ig. G 400 мг/кг Аспирин При неэффективности – кортикостероиды Прогноз – 80% - полное выздоровление. Аневризмы коронарных артерий могкт сохраняться до нескольких месяцев
Болезнь Kawasaki - лечение Внутривенное введение Ig. G 400 мг/кг Аспирин При неэффективности – кортикостероиды Прогноз – 80% - полное выздоровление. Аневризмы коронарных артерий могкт сохраняться до нескольких месяцев
 ANCA ассоциированные васкулиты Лечение WG u. Стероиды u. Циклофосфамид u. Плазмаферез u. Азатиоприн u. Метотрексат u. Ко-тримоксазол MPA u. Проспективные исследования отсутствуют u. Стероиды u. Азатиоприн u. Циклофосфамид
ANCA ассоциированные васкулиты Лечение WG u. Стероиды u. Циклофосфамид u. Плазмаферез u. Азатиоприн u. Метотрексат u. Ко-тримоксазол MPA u. Проспективные исследования отсутствуют u. Стероиды u. Азатиоприн u. Циклофосфамид
 Грануломатоз Wegener Некротизирующий грануломатозный васкулит верхних и нижних дыхательных путей Малоиммунный гломерулонефрит Некротизирующий васкулит мелких и средних сосудов
Грануломатоз Wegener Некротизирующий грануломатозный васкулит верхних и нижних дыхательных путей Малоиммунный гломерулонефрит Некротизирующий васкулит мелких и средних сосудов
 Грануломатоз Wegener Чаще встречается у взрослых (средний возраст- 40 лет, М=Ж) Повышение c. ANCA- антинейтрофильных антител к протеиназе 3 Активация процессов апоптоза Возможна связь с инфекциями и факторами окружающей среды
Грануломатоз Wegener Чаще встречается у взрослых (средний возраст- 40 лет, М=Ж) Повышение c. ANCA- антинейтрофильных антител к протеиназе 3 Активация процессов апоптоза Возможна связь с инфекциями и факторами окружающей среды
 Грануломатоз Wegener- диагностика Язвы полости рта или кровянисто-гнойные выделения из носа, синусит Наличие полостей или нодулярных и инфильтративных изменений в легких Микрогематурия >5 эритроцитов в поле зрения и эритроцитарных цилиндров Гистологические признаки грануломатозного воспаления сосудистой стенки либо периваскулярной и экстраваскулярной зоны Для диагноза достаточно 2 из 4 признаков в сочетании с явлениями васкулита
Грануломатоз Wegener- диагностика Язвы полости рта или кровянисто-гнойные выделения из носа, синусит Наличие полостей или нодулярных и инфильтративных изменений в легких Микрогематурия >5 эритроцитов в поле зрения и эритроцитарных цилиндров Гистологические признаки грануломатозного воспаления сосудистой стенки либо периваскулярной и экстраваскулярной зоны Для диагноза достаточно 2 из 4 признаков в сочетании с явлениями васкулита
 Грануломатоз Wegener-диагностика Поражение почек (80 -90%) – быстропрогрессирующий ГН с некрозом и полулуниями, с негативной иммунофлуоресценцией. Протеинурия и гематурия небольшие. ТХПН- 11 -32% Изменения глаз (28 -58%): конъюнктивит, кератит, склерит, увеит, экзофтальм Поражение нервной системы (10%)- васкулит ЦНС, менингит Артралгии, поражения ЖКТ-редки Повышение c. ANCA –у 90%, ускорение СОЭ, лейкоцитоз, тромбоцитоз, повышение C-RP
Грануломатоз Wegener-диагностика Поражение почек (80 -90%) – быстропрогрессирующий ГН с некрозом и полулуниями, с негативной иммунофлуоресценцией. Протеинурия и гематурия небольшие. ТХПН- 11 -32% Изменения глаз (28 -58%): конъюнктивит, кератит, склерит, увеит, экзофтальм Поражение нервной системы (10%)- васкулит ЦНС, менингит Артралгии, поражения ЖКТ-редки Повышение c. ANCA –у 90%, ускорение СОЭ, лейкоцитоз, тромбоцитоз, повышение C-RP

 Современный подход к идукции ремиссии при ANCA-ассоциированных васкулитах. Harper. Current Opinion in Rheumatology. 2010. Тяжесть болезни Определение European Vasculitis Study Group Локализованн ый Поражение верхних и/или MTX и нижних дыхательных путей без стероиды системного или конституционального вовлечения Ранний системный Любые проявления без угрозы для функции органов и жизни MTX или CYC и стероиды Генерализован ный Почечная и другая органная угроза; Creat 500 стероиды + μmol/L плазмаферез Терапия индукции © 2010 Lippincott Williams & Wilkins, Inc. Published by Lippincott Williams & Wilkins, Inc.
Современный подход к идукции ремиссии при ANCA-ассоциированных васкулитах. Harper. Current Opinion in Rheumatology. 2010. Тяжесть болезни Определение European Vasculitis Study Group Локализованн ый Поражение верхних и/или MTX и нижних дыхательных путей без стероиды системного или конституционального вовлечения Ранний системный Любые проявления без угрозы для функции органов и жизни MTX или CYC и стероиды Генерализован ный Почечная и другая органная угроза; Creat 500 стероиды + μmol/L плазмаферез Терапия индукции © 2010 Lippincott Williams & Wilkins, Inc. Published by Lippincott Williams & Wilkins, Inc.
 Микроскопический полиангиит Системный некротизирующий васкулит мелких сосудов с фокально-сегментарным гломерулонефритом без гранулом Присутствие p. ANCA- анти-MPO Средний возраст-50 лет, М>Ж Клиника- миалгии, артриты, кожная пурпура, боли в животе, лихорадка, кровоточивость, нейропатия, поражения глаз и ЛОР-органов, легких БПГН с полулуниями и некрозами, но без гранулом
Микроскопический полиангиит Системный некротизирующий васкулит мелких сосудов с фокально-сегментарным гломерулонефритом без гранулом Присутствие p. ANCA- анти-MPO Средний возраст-50 лет, М>Ж Клиника- миалгии, артриты, кожная пурпура, боли в животе, лихорадка, кровоточивость, нейропатия, поражения глаз и ЛОР-органов, легких БПГН с полулуниями и некрозами, но без гранулом
 Микроскопический полиангиит-лечение Кортикостероиды до 12 месяцев: начиная с МП 20 мг/кг в/в (3 дня) с переходом на прием внутрь 1 мг/кг с последующим снижением Циклофосфамид в/в или внутрь Азатиоприн иили метотрексат для поддержания ремиссии
Микроскопический полиангиит-лечение Кортикостероиды до 12 месяцев: начиная с МП 20 мг/кг в/в (3 дня) с переходом на прием внутрь 1 мг/кг с последующим снижением Циклофосфамид в/в или внутрь Азатиоприн иили метотрексат для поддержания ремиссии
 Сравнение Ритуксимаба и Циклофосфамида при ANCAассоциированном почечном васкулите European Vasculitis Study Group. NEJM 2010 Мнргоцентровое, открытое, рандомизированное исследование. Поддержание ремиссии – Нет различий – RTX 25 (76%) v. ЦФ 9 (82%) Серьезные побочные эффекты – Нет различий – RTX - 14 (42%) v. ЦФ- 4 (36%) Смертность RTX 6 (18%) v. control 2 (18%)
Сравнение Ритуксимаба и Циклофосфамида при ANCAассоциированном почечном васкулите European Vasculitis Study Group. NEJM 2010 Мнргоцентровое, открытое, рандомизированное исследование. Поддержание ремиссии – Нет различий – RTX 25 (76%) v. ЦФ 9 (82%) Серьезные побочные эффекты – Нет различий – RTX - 14 (42%) v. ЦФ- 4 (36%) Смертность RTX 6 (18%) v. control 2 (18%)
 Ритуксимаб в сравнении с ЦФ при ANCA-ассоциированных васкулитах. RAVE−ITN Research Group. NEJM 2010 Многоцентровое двойное слепое рандомизированное исследование RTX не уступал по: – Числу ремиссий без преднизолона ч-з 6 мес. – Включая рецидивирующие формы: RTX 34/51 (67%) v. CYC 21/50 (42%) (P=0. 01) – RTX столь же эффективен как и ЦФ при: Болезни почек Геморрагическом альвеолите Не было различий в частоте побочных эффектов
Ритуксимаб в сравнении с ЦФ при ANCA-ассоциированных васкулитах. RAVE−ITN Research Group. NEJM 2010 Многоцентровое двойное слепое рандомизированное исследование RTX не уступал по: – Числу ремиссий без преднизолона ч-з 6 мес. – Включая рецидивирующие формы: RTX 34/51 (67%) v. CYC 21/50 (42%) (P=0. 01) – RTX столь же эффективен как и ЦФ при: Болезни почек Геморрагическом альвеолите Не было различий в частоте побочных эффектов
 Узелковый полиартериит (Polyarteriitus nodosa) Некротизирующий васкулит с аневризматическими узелками по ходу мышечных артерий среднего калибра Более характерен для детей, чем WG или микроскопический полиангиит
Узелковый полиартериит (Polyarteriitus nodosa) Некротизирующий васкулит с аневризматическими узелками по ходу мышечных артерий среднего калибра Более характерен для детей, чем WG или микроскопический полиангиит
 Узелковый полиартериит (Polyarteriitus nodosa)клиника Лихорадка Слабость Кожные высыпания Миалгии Потеря веса Боли в животе Артропатии Поражение почек, Гипертония
Узелковый полиартериит (Polyarteriitus nodosa)клиника Лихорадка Слабость Кожные высыпания Миалгии Потеря веса Боли в животе Артропатии Поражение почек, Гипертония
 Узелковый полиартериит (Polyarteriitus nodosa)диагностика Полиморфонуклеарный лейкоцитоз Ускорение СОЭ Тромбоцитоз Повышение C-RP Присутствие c. ANCA и p. ANCA Часто – HBs. Ag+ Наличие аневризм сосудов на ангиографии почек или печени Гломерулонефрит
Узелковый полиартериит (Polyarteriitus nodosa)диагностика Полиморфонуклеарный лейкоцитоз Ускорение СОЭ Тромбоцитоз Повышение C-RP Присутствие c. ANCA и p. ANCA Часто – HBs. Ag+ Наличие аневризм сосудов на ангиографии почек или печени Гломерулонефрит
 Узелковый полиартериит (Polyarteriitus nodosa)лечение Циклофосфамид в/в или внутрь Кортикостероиды в/в или внутрь Антитромбоцитарная терапия Плазмаферез В/в иммуноглобулин G Симптоматическое лечение
Узелковый полиартериит (Polyarteriitus nodosa)лечение Циклофосфамид в/в или внутрь Кортикостероиды в/в или внутрь Антитромбоцитарная терапия Плазмаферез В/в иммуноглобулин G Симптоматическое лечение
 Синдром Churg-Strauss- аллергический грануломатоз с ангиитом 1. 2. 3. 4. 5. 6. Астма с длительным предшествующим течением Эозинофилия свыше 10% Моно- и полинейропатия Рентгенологические признаки легочных инфильтратов Патология Гайморовых пазух Экстраваскулятная эозинофилия по данным биопсии Для диагноза достаточно 4 из 6 признаков
Синдром Churg-Strauss- аллергический грануломатоз с ангиитом 1. 2. 3. 4. 5. 6. Астма с длительным предшествующим течением Эозинофилия свыше 10% Моно- и полинейропатия Рентгенологические признаки легочных инфильтратов Патология Гайморовых пазух Экстраваскулятная эозинофилия по данным биопсии Для диагноза достаточно 4 из 6 признаков
 Синдром Churg-Strauss Средний возраст 38 -49 лет, М=Ж У 2/3 – кожные проявления У 60% - моно- и полиневриты p. ANCA к MPO – у 50 -70% больных Поражение почек – у 50% больных, не носит тяжелого характера, БПГН реже, признаки почечного васкулита, эозинофильная инфильтрация интерстиция. Терапия- кортикостероиды с хорошим эффектом, цитостатики требуются редко
Синдром Churg-Strauss Средний возраст 38 -49 лет, М=Ж У 2/3 – кожные проявления У 60% - моно- и полиневриты p. ANCA к MPO – у 50 -70% больных Поражение почек – у 50% больных, не носит тяжелого характера, БПГН реже, признаки почечного васкулита, эозинофильная инфильтрация интерстиция. Терапия- кортикостероиды с хорошим эффектом, цитостатики требуются редко
Люпус-нефрит является одним из наиболее частых осложнений системной красной волчанки. СКВ - это аутоиммунное заболевание, вызванное появлением в организме антител, воспринимающих «родные» белки как чужеродные. Вследствие этого развивается асептическое воспаление в разных частях тела. В том числе и в почках.
Определение
Люпус-нефрит, или волчаночный нефрит - это тяжелое заболевание почек при Распространенность этого заболевания в популяции в среднем сорок человек на сто тысяч населения. Чаще всего болеют представители прекрасной половины в возрасте от двадцати до сорока лет. Чаще всего патология встречается в афро-карибской популяции.
Заболевание может быть вызвано самыми разнообразными факторами: от чрезмерного увлечения загаром, до генетических нарушений, поэтому крайне важно вовремя обратить внимание на симптомы и пойти к врачу. Ведь чем раньше будет начато лечение, тем лучше прогноз для жизни и здоровья пациента.

Этиология
Люпус-нефрит может быть спровоцирован постоянной длительной инсоляцией (увлечение солярием или проживание в солнечных местах), аллергией на лекарственные препараты, перманентным стрессом и даже беременностью (плод воспринимается как чужеродный организм и иммунная система начинает атаковать клетки матери).
Кроме того, на развитие заболевания влияют генетические склонности, наличие гормонального дисбаланса, частые вирусные заболевания (вирусы встраиваются в клетки организма, оставляя на их поверхности свои антигены и провоцируют, таким образом, иммунный ответ). Шанс развития заболевания у близких родственников в несколько раз выше, чем в среднем по популяции.

Патогенез
Люпус-нефрит является частью большого симптомокомплекса, развивающегося при системной красной волчанке. Аутоантитела в первую очередь развиваются к нативной ДНК и ее соединению с гистонами, к белкам и кардиолипину. Причина такое агрессии - снижение толерантности к собственным антигенам, дефекты В и Т-лимфоцитов.
Непосредственно развитие нефрита связывают с тем, что комплексы антиген-антител тропны к тканям почечных канальцев. Как только такая белковая молекула прикрепляется на поверхности клетки, она запускает каскад биохимических реакций, в результате которых высвобождаются активные вещества, расплавляющие клетки. Это, в свою очередь, вызывает воспалительную реакцию, которая только усугубляет разрушения.

Патоморфология
Люпус-нефрит при СКВ может иметь различные морфологические проявления. При вскрытии больных отмечается изменение в мембранах клубочков почек, активное деление их клеток, расширение мезангиума, склероз сосудистых петель и другое. Эти проявления могут быть одновременно как в одном, так и в нескольких клубочках.
Наиболее специфичным для волчаночного нефрита является фибриноидный некроз капилляров петли Генле, а также гистологически выявляемый кариопикноз и кариорексис (разделение и лизис ядра клетки). Кроме того, патогномоничным является изменение базальных мембран клубочков в виде «проволочных петель» и наличие гиалиновых тромбов в просвете капилляров как следствие отложения иммунных комплексов.
Классификация
Клинически и морфологически можно выделить несколько стадий, которые проходит люпус-нефрит. Классификация Всемирной организации здравоохранения выглядит так:
- Первый класс: клубочки имеют нормальную структуру.
- Второй класс: имеются только изменения мезангия.
- Третий класс: гломерулонефрит с поражением половины всех клубочков.
- Четвертый класс: диффузный гломерулонефрит.
- Пятый класс: мембранозный гломерулонефрит.
- Шестой класс: склерозирующий гломерулонефрит.
Существует также классификация Серова, в которой он выделяет очаговый, диффузный, мембранозный, мезангиопролиферативный, мезангиокапиллярный и фибропластический гломерулонефрит.

Симптомы
Мембранозный люпус-нефрит имеет как облигатные, так и факультативные симптомы. Одним из обязательных его проявлений является протеинурия, то есть наличие белка в моче. Также часто можно встретить гематурию, лейко - и лимфоцитурию. Эти признаки свидетельствуют о наличии воспалительного процесса в почках и могут быть не только при СКВ.
С прогрессированием аутоиммунного процесса нарастают симптомы почечной недостаточности, проявляющиеся повышением уровня креатинина в крови и моче, слабостью, вялостью больного,
Выделяют медленно прогрессирующий и быстро прогрессирующий нефрит. Если заболевание развивается медленно, то превалируют мочевой и нефротический синдром. Кроме того, волчаночный нефрит может проходить в неактивной или скрытой форме, когда из всех симптомов присутствует только незначительная протеинурия.
Быстро прогрессирующий люпус-нефрит очень похож на классический гломерулонефрит. Почечная недостаточность стремительно растет, появляется макрогематурия, повышение артериального давления и нефротический синдром. В тяжелых случаях может развиваться синдром диссеминированного внутрисосудистого свертывания (ДВС).
Люпус-нефрит у детей
У 1/5 всех больных системной красной волчанкой первые симптомы заболевания появились еще в детстве. У детей младше 10 лет она практически не встречается, но есть описание случаев СКВ у ребенка полутора месяцев от роду.
Развитие заболевания у малышей не отличается от такового у взрослых. Клиническая картина может быть разнообразной: от бессимптомного течения до быстропрогрессирующего. развивается редко.
Выделяют несколько признаков СКВ у ребенка:
- эритема на лице;
- дискоидные высыпания по телу;
- чувствительность к солнечным лучам;
- язвы на слизистых;
- воспаления суставов;
- поражение почек;
- нарушение со стороны ЦНС;
- повышенная кровоточивость;
- иммунологические нарушения;
- наличие антинуклеарных антител.
Если в клинике присутствует хотя бы четыре признака из этого списка, то можно уверенно заявить, что у ребенка системная красная волчанка. Поражение почек в детском возрасте редко выходит на первый план. Как правило, симптомы могут варьироваться от гломерулонефрита до проявлений антифосфолипидного синдрома.
Прогноз развития заболевания у детей более благоприятный. Через десять лет после постановки диагноза диализ требуется только 10 процентам пациентов.

Диагностика
Что дает врачу повод заподозрить люпус-нефрит? Диагностика, как правило, опирается на уже имеющиеся клинические и лабораторные подтвержденные данные об СКВ:
- боли и воспаление в суставах;
- высыпания на коже лица в виде бабочки;
- наличие в анамнезе выпота в полости (плеврит, перикардит);
- быстрая потеря массы тела, повышение температуры.
В общем анализе крови наблюдается анемия, снижение тромбоцитов, повышение скорости оседания эритроцитов, снижение белков комплемента. Для диагностики важно выявить антитела к нативной ДНК.
Как правило, этого бывает достаточно, чтобы поставить диагноз системной красной волчанки и, как следствие, волчаночного нефрита. Однако появление белка в моче может запаздывать на один-два года от манифестации заболевания. В таком случае врач полагается на иммуноферментный анализ и обнаружение антител. Если нет подтвержденных лабораторных данных, то нужно продолжать диагностический поиск, особенно это касается пациентов мужского пола, так как для них данная нозология достаточно редка.
Дифференцируют люпус-нефрит при СКВ с бактериальным эндокардитом, обострениями ревматоидного артрита, миеломной болезнью, хроническим гепатитом, амилоидозом и синдромом Шенлейна-Геноха.
Первый этап лечения
Лечение люпус-нефрита - это длительный и кропотливый процесс, который зачастую длится всю оставшуюся жизнь. Он проходит в два этапа. На первом этапе купируется обострение болезни. Цель лечения - добиться стойкой ремиссии, или хотя бы снизить клинические проявления.
Прием лекарств должен начаться как можно раньше от момента постановки диагноза. Все происходит настолько быстро, что даже задержка в пять-семь дней может стать фатальной ошибкой. Если активность процесса невысока (это покажут титры антител), то врач может ограничиться назначением кортикостероидов в высоких дозах сроком на два месяца с последующим медленным снижением дозировки (резко отменять препарат нельзя, могут отказать надпочечники).
Если течение заболевания более бурное, то, помимо стероидов, внутривенно вводят большие дозы цитостатиков. Такую пульс-терапию проводят в течение полугода. И только по истечении этого срока можно начинать снижать дозы препаратов и переводить больного на пероральный прием лекарств.
Не стоит забывать, что у больных с СКВ часто развивается ДВС синдром, поэтому рекомендуется предпринимать профилактические меры, а именно:
- переливания крови и ее компонентов;
- внутривенное введение "Трентала";
- подкожное введение 2,5 тысячи единиц "Гепарина".
Второй этап лечения
Люпус-нефрит при СКВ на втором этапе также лечится стероидными гормонами и цитостатиками. Только доза их значительно меньше. Очень медленно, в течение четырех-шести месяцев дозу "Преднизолона" титруют до 10 миллиграмм на килограмм веса. Цитостатики тоже назначаются болюсными дозами один раз в три месяца, а если сохраняется положительная динамика заболевания, то переходят на однократную инъекцию в полгода.
Такая поддерживающая терапия может длиться годами. Со временем к ней добавляется (по необходимости) профилактика побочных эффектов от лекарств и
Но даже при своевременно начатом лечении у пятнадцати процентов больных все равно развивается почечная недостаточность. В таком случае могут помочь только сеансы гемодиализа либо трансплантация почек. К сожалению, такие методы лечения не доступны широким слоям населения.

Диета при люпус-нефрите
Для того чтобы поддерживать функцию почек, пациенты с волчаночным нефритом должны придерживаться определенных правил:
- Пить много жидкости, чтобы хорошо фильтровать кровь и поддерживать уровень обмена веществ.
- Пища должна содержать незначительное количество калия, фосфора и белка, так как эти элементы негативно действуют на поврежденные почки.
- Отказаться от вредных привычек.
- Заниматься легким спортом.
- Регулярно проверять артериальное давление.
- Ограничить прием жирной пищи.
- Не принимать НПВС, так как они негативно влияют на почки.
Прогноз
Прогноз лечения люпус-нефрита мембранозного зависит от того, насколько серьезно поражены почки и времени начала терапии. Чем раньше пациент обращается к врачу, тем больше вероятность благоприятного исхода.
Еще сорок лет назад только единицы больных с волчаночным нефритом жили более года от момента постановки диагноза. Благодаря современным методам лечения и диагностики, пациенты могут рассчитывать на более чем пятилетнюю продолжительность жизни.
4896 0
Поражение почек
Механизм развития волчаночного нефрита отражает патогенез СКВ в целом. Это классическое иммунокомплексное заболевание, для которого характерна неконтролируемая продукция антител, образующих иммунные комплексы, обусловливающие поражение почек.
Изучение патогенеза нефрита в эксперименте наглядно показало патогенетическую обусловленность различных типов поражения почек в зависимости от характера иммунного ответа. Так, у гибрида новозеландских мышей B/W развивается прогрессирующий иммунокомплексный гломерулонефрит, как правило, со смертельным исходом. Подобный злокачественный нефрит, рано приводящий к смерти развивается у мышей линии MRL/MPlpr/lpr (близкой к MRL/I).
В то же время у другой линии мышей — MRL/n, отличающейся по единственному генетическому локусу от указанных животных, развивается умеренное поражение почек, не влияющее на продолжительность жизни животных. У мышей линии BXSB развиваются тяжелый нефрит и аутоиммунная гемолитическая анемия. Гистопатологические изменения в почках при аутоиммунном нефрите у мышей аналогичны таковым при люпус-нефрите у людей, хотя имеются некоторые особенности.
Так, у мышей линии NZB гистологические проявления в почках ограничиваются мембранозным типом нефрита, а у других линий мышей развивается в основном диффузный пролиферативный нефрит. Моделью, почти абсолютно близкой к человеческой, является нефрит у гибридов NZB/NZW f|, что дало возможность детально изучить гистологические изменения и выделить морфологические типы нефрита, доказать его иммунокомплексную природу, выделив из гломерул иммунные комплексы, содержащие ДНК, антиДНК, IgG, C3 и другие компоненты иммунного ответа.
Морфологические изменения в почках при СКВ встречаются значительно чаще, чем клинические проявления нефрита. Иммунофлюоресцентное исследование биоптата или патологоанатомического материала почки практически у всех больных позволяет выявить депозиты иммуноглобулинов или фракций комплемента в базальной мембране гломерул . Гистологические изменения в биоптате находят более чем у половины больных СКВ без клинических признаков нефрита.
Морфология волчаночного нефрита отличается полиморфизмом. Помимо гистологических изменений, свойственных гломерулонефриту вообще (пролиферация мезангиальных и эпителиальных клеток, расширение мезангиума, изменения базальных мембран капилляров и др.), отмечают и изменения, достаточно специфичные именно для СКВ, — фибриноидный некроз капиллярных петель, кариопикноз и кариорексис, гематоксилиновые тельца, гиалиновые тромбы, «проволочные петли» (рис. 4.14 и 4.15). В биоптатах почек эти признаки встречаются с различной частотой, при этом картина варьирует . Выраженность и распространенность изменений в интерстиции, канальцах, сосудах четко коррелируют с тяжестью поражения гломерул. Изолированные тубулоинтерстициальные изменения казуистически редки.
Рис. 4.14. Биоптат почки больной системной красной волчанкой острого течения. Диффузный гломерулонефрит. Фибриноидный некроз петель с признаками ядерной патологии, начало образований полулуний. Лимфоидный инфильтрат в окружности клубочка. Ув.Х200.

Рис. 4.15. Отложение IgG в капиллярных петлях клубочка почки (та же больная).
С 1982 г. за рубежом используется в основном классификация волчаночного нефрита, предложенная ВОЗ, с небольшими модификациями каждого из исследователей . Эта классификация включает б классов: I — отсутствие изменений в биоптате; II — мезангиальный нефрит; III — очаговый пролиферативный гломерулонефрит; IV — диффузный пролиферативный гломерулонефрит; V — мембранозный гломерулонефрит; VI — склерозирующий гломерулонефрит.
В основе отечественной классификации волчаночного нефрита [Серов В. В. и др., 1980] лежат характер морфологических изменений и распространенность процесса. Выделяют следующие типы гломерулонефрита:
1) очаговый волчаночный пролиферативный;
2) диффузный волчаночный пролиферативный;
3) мембранозный;
4) мезангиомембранозный;
5) мезангиопролиферативный;
6) мезангиокапиллярный;
7) фибропластический.
Имеются определенные параллели между этими двумя классификациями: II класс ВОЗ близок мезангиомембранозному гломерулонефриту по классификации В. В. Серова и соавт., III класс включает в себя лишь часть случаев, описываемых В. В. Серовым и соавт. под названием «очаговый пролиферативный гломерулонефрит», так как «очаговость» и «диффузность» по классификации ВОЗ определяются степенью распространенности всех гистологических изменений, а по классификации В. В. Серова — степенью распространенности лишь специфических волчаночных признаков.
Соответственно класс IV включает в себя не только «диффузный пролиферативный волчаночный нефрит» В. В. Серова и соавт., но и часть случаев «очагового пролиферативного волчаночного нефрита», а также случаи мезангиопролиферативного, мезангиокапиллярного и, очевидно, фибропластического нефрита. Наконец, V класс ВОЗ полностью соответствует мембранозному нефриту в классификации В. В. Серова и соавт. Данные о частоте различных морфологических типов волчаночного нефрита представлены в табл. 4.3.
При иммуногистохимическом исследовании в клубочках чаще выявляются IgG, C3, фибрин; несколько реже — IgM и IgA, отдельно или в сочетании.
При электронномикроскопическом исследовании находят субэндотелиальные, иногда одновременно субэпителиальные и/или интрамембранозные, мезангиальные отложения иммунных комплексов.
Таблица 4.3. Частота различных морфологических типов гломерулонефрита при системной красной волчанке по данным биоптата почек (собственные наблюдения и данные литературы)
|
Тип гломеруло нефрита по В. В.Серову и соавт., 1980 |
Класс |
им. И.М.Се ченова; |
Институт ревматоло АМН СССР, |
Leaker B. et al., 1986; |
Appel G. В. et al., 1987; |
|
|
|
124 биопсии |
54 биопсии |
135 биопсий |
56 биопсий |
|
Мезангиомембра |
| ||||
|
|
|
|
|
|
|
|
Очаговый волча | |||||
|
ночный проли |
|
|
|
|
|
|
феративный |
|
|
|
|
|
|
Диффузный волча |
|
|
|||
|
ночный пролй |
|
|
|
(слабо вы |
|
|
феративный |
|
|
|
раженный) |
|
|
|
|
|
| ||
|
|
|
|
|
(тяжелый) |
|
|
Мезангиопролифе |
| ||||
|
ративный |
|
|
|
|
|
|
Мезангиокапилляр |
|
| |||
|
|
|
|
|
|
|
|
Фибропластиче |
|
| |||
|
|
|
|
|
|
|
|
Мембранозный |
Депозиты являются маркером волчаночного нефрита и определяют тяжесть гистологических изменений . При СКВ эти отложения нередко имеют характерную зернистую структуру и выглядят как отпечатки пальцев. Именно такого вида депозиты, расположенные в мезангиуме или субэндотелиально, характерны для волчаночного нефрита.
Патогномоничным признаком нефрита волчаночной природы являются внутриэндотелиальные вирусоподобные включения в капиллярах клубочка, напоминающие миксовирусы.
Помимо изменений клубочков, в половине случаев выражены тубулоинтерстициальные изменения — гиалиново-капельная и вакуольная дистрофия эпителия канальцев, субатрофия и атрофия эпителия, мононуклеарные инфильтраты в интерстиции, нейтрофилы и эозинофилы, очаги склероза, часто с отложением иммунных комплексов и комплемента в интерстиции и на тубулярной базальной мембране.
Повторные исследования биоптата в динамике показывают, что выделенные морфологические типы гломерулонефрита не какая-то постоянная клинико--патологическая сущность, а различные стадии динамического процесса. Известны случаи, когда по биоптату невозможно четко определить морфологический тип согласно классификации ВОЗ, что возможно объясняется проведением биопсии в момент перехода одной формы в другую .
Определение морфологического типа гломерулонефрита весьма полезно при выборе схемы терапии. Для оценки прогноза по данным биопсии почки используют индекс хронизации, который включает такие признаки, как гломерулосклероз, фиброзные полулуния, атрофию канальцев и интерстициальный фиброз .
Индекс хронизации дает возможность предсказать сроки развития почечной недостаточности. Так, при наличии хотя бы одного из этих признаков вероятность развития почечной недостаточности к 5-му году составляет 25%, к 10му у 40%, в то время как при отсутствии подобных изменений риск возникновения почечной недостаточности к 5-му году болезни равен нулю, а к 10му — примерно 10% .
1. Системная красная волчанка, острое течение, степень активности III, эритема кожи лица в виде «бабочки», капилляриты на ногтевых фалангах, полиартрит, экссудативный плеврит, перикардит, гломерулонефрит, кахексия, алопеция.
2. Системная красная волчанка, подострое течение, степень активности II, эритема в виде «бабочки», полиартрит, правосторонний экссудативный плеврит, перикардит, мембранозно- пролиферативный гломерулонефрит. ХСН I ст, II ФК, ХБП I ст.
3 . Системная красная волчанка, хроническое течение, степень активности I, дискоидные очаги в области лба, полиартралгии, интерстициальная пневмония.
Клиническая картина
Наиболее типичны случаи, когда заболевание начинается исподволь с общих проявлений в виде лихорадки с ознобами, связанными с повышением температуры тела, недомогания, быстрой утомляемости, болей в суставах, возможно с их припуханием, а также появления различных кожных высыпаний, чаще на лице по типу «бабочки». Больные могут не сразу обратиться к врачу, поскольку прием обезболивающих и противовоспалительных препаратов (аспирина, парацетамола) облегчает состояние пациента, а в некоторых случаях первые проявления СКВ могут самостоятельно исчезнуть на какой-то промежуток времени. Очередные обострения провоцируются инсоляцией или беременностью и появляются новые симптомы системной красной волчанки. В течение 5-10 лет развивается характерная клиническая картина болезни с вовлечением в патологический процесс многих органов.
В 20-30% случаев первым признаком СКВ является поражение почек, сопровождающееся повышением артериального давления. Если боли в суставах не предшествуют появлению изменений в моче, то такой пациент, как правило, попадает на прием к нефрологу. В большинстве случаев именно поражение почек и определяет в дальнейшем прогноз.
При остром начале СКВ больной способен указать не только день, но и время, когда заболел, высокая лихорадка, выраженный суставной синдром с припуханием многих суставов, общая слабость, головная боль - вот первые симптомы заболевания. Больные с быстро прогрессирующим течением СКВ могут погибнуть в ближайшие 1-2 года.
При объективном обследовании больных СКВ выявляются симптомы и синдромы, обусловленные активностью болезни (лихорадка, артриты, кардит и др.) или развитием необратимых изменений в органах и системах вследствие обострений болезни (почечная недостаточность, фиброз легких, органические изменения психического состояния и др.), а также связанные с побочными эффектами проводимой терапии (асептический некроз костей, вторичные инфекционные осложнения, ранний атеросклероз)
Наиболее характерные клинические проявления системной красной волчанки
|
Симптомы |
Частота, % |
|
Артрапгии | |
|
Лихорадка | |
|
Слабость | |
|
Поражение кожи | |
|
Поражение почек | |
|
Эритема на лице «бабочка» | |
|
Фотосенсибилизация | |
|
Выпадение волос | |
|
Феномен Рейно | |
|
Потери сознания | |
|
Язвочки на губах и слизистой носа |
Общие признаки СКВ
В90% случаев пациенты жалуются на общую слабость. Артралгии и миалгии часто сочетаются с недомоганием и быстрой утомляемостью. Реже наблюдается лихорадка и потеря массы тела, однако эти признаки заболевания являются неблагоприятными и отражают активность СКВ.
Поражение слизистых оболочек и кожи
Язвочки на слизистых оболочках являются нередким признаком СКВ и наблюдаются примерно у 30% больных. Их преимущественной локализацией является красная кайма губ и слизистые оболочки носовых ходов. Язвочки, как правило, безболезненны и редко выявляются самими больными. Однако они могут осложняться развитием вторичной инфекции, в том числе кандидозной.
Вторым по частоте проявлением СКВ является поражение кожи. Типичными являются эритематозные высыпания (покраснение), несколько возвышающиеся над неизмененными участками кожи, со стертым контуром и симметричным расположением в виде «бабочки», которая затрагивает спинку носа и скуловые дуги, однако может распространяться на лоб и подбородок Данные изменения могут быть постоянными или преходящими, появляющимися в периоды обострения заболевания и исчезающими во время ремиссии.
У 25% больных СКВ проявляется дискоидными кожными изменениями, характеризующимися сыпью в виде пузырьков в области шеи и верхней половины туловища, после разрешения которой остаются мелкие рубчики. Провоцирующим фактором любых кожных поражений при СКВ может являться инсоляция.
Иногда, преимущественно на коже нижних конечностей, наблюдаются геморрагические мелкоточечные высыпания размером с булавочную головку, которые могут быть обусловлены либо тромбоцитопенией, либо геморрагическим васкулитом.
В некоторых случаях, особенно при вторичном антифосфолипидном синдроме, отмечается сетчатое ливедо (мраморный рисунок кожи в области конечностей и туловища) .
Возможно выпадение волос в период обострения заболевания, которое может носить как распространенный характер, так и гнездный. Требуется несколько месяцев для того, чтобы они отросли вновь. В некоторых случаях волосы на голове начинают ломаться на расстоянии 1-3 см от поверхности кожи в лобной и височной областях по линии роста волос.
Рисунок. А. Высыпания на скулах. В. Подострая кожная форма красной волчанки. С. Дискоидные очаги.
У каждого третьего больного СКВ наблюдается феномен Рейно, для которого характерны изменения цвета кожи кистей или стоп (побеление и/или цианоз) не постоянного, а приступообразного характера. Типичным является двух- или трехфазный характер нарушений кровотока, когда вслед за побелением и/или цианозом пальцев развивается гиперемия. Трофические расстройства кожи пальцев возникают постепенно, причем, как правило, ограничиваются кончиками пальцев.
Поражение опорно-двигательного аппарата
Приблизительно 90% пациентов с СКВ имеют суставной синдром в виде артралгий или артритов. Наиболее часто больные предъявляют жалобы на боли в мелких суставах кистей и стоп (межфаланговые, пястно-фаланговые), однако могут поражаться средние (лучезапястные) и крупные суставы (коленные, голеностопные). В отличие от ревматоидного артрита поражение суставов при СКВ не носит явно эрозивный характер, а следовательно, не развивается их деформация. Пораженные суставы могут припухать с явлениями гиперемии кожи. Артриты могут сопровождаться вовлечением в патологический процесс периартикулярных мягких тканей, прежде всего связок. Однако артрит обычно бывает нестойкий и со временем исчезает. Это может приводить к развитию артропатии Жаку, особенностью которой является формирование подвывихов, что напоминает деформации.

Рисунок. Деформация пальцев по типу «лебединой шеи» при СКВ.
В ряде случаев развиваются интенсивные боли в тазобедренных суставах, что, как правило, обусловлено развитием асептического некроза головок бедренных костей.
Часто у больных СКВ наблюдаются боли в мышцах, усиливающиеся при надавливании на них. В дальнейшем развивается мышечная слабость и атрофия. Реже во время очередного обострения может развиваться миозит. Боли в мышцах могут также быть обусловлены миопатией, индуцированной ГКС. Явный миозит сопровождается повышением в крови таких ферментов, как креатинкиназа, лактатдегидрогеназа или альдолаза.
Серозиты
Плеврит, перикардит, асептический перитонит могут иметь место у каждого второго пациента с СКВ. Причем количество выпота в серозные полости обычно бывает незначительным. Однако в некоторых случаях возможны экссудативные серозиты с большим количеством выпота и развитием таких осложнений, как тампонада сердца, дыхательная и сердечная недостаточность.
Поражение сердечно-сосудистой системы
Часто встречающимися признаками поражения сердечно-сосудистой системы при СКВ являются кардиалгии, сердцебиение, аритмии, одышка при физической нагрузке и даже в покое. Указанные симптомы могут быть обусловлены экссудативным перикардитом или миокардитом, что в дальнейшем может привести к нарастающей сердечной недостаточности. По данным различных авторов, частота развития перикардита может достигать 30% (по результатам аутопсий), однако, как правило, перикардит протекает бессимптомно и редко приводит к таким тяжелым осложнениям, как тампонада сердца.
Миокардиты развиваются примерно в 25% случаев и часто сочетаются с перикардитом. Основными признаками миокардита являются: расширение границ сердца, глухость тонов, тахиаритмия, изменение сегмента SТ-Т и повышение МВ- фракции креатинкиназы.
При СКВ в патологический процесс может также вовлекаться эндокард, особенностью поражения которого является развитие асептического эндокардита Либмана-Сакса, протекающего с утолщением пристеночного эндокарда в области атриовентрикулярного кольца. Чаще в патологический процесс вовлекаются митральный и аортальный клапаны. Указанные патоморфологические изменения обычно обнаруживаются при
аутопсии.
При вторичном антифосфолипидном синдроме описаны случаи тромботического вальвулита и тромбоза камер сердца. Коронарит при активной СКВ может привести к развитию инфаркта миокарда с типичными для стенокардии ангинозными приступами.
У женщин с СКВ в пременопаузальном периоде высок риск развития атеросклероза (6-10%). Механизм формирования атеросклероза при СКВ сложен и обусловлен отложением депозитов иммунных комплексов в стенке сосудов. Дополнительное влияние на формирование атеросклероза может оказывать длительная терапия ГКС за счет гиперлипидемии и гипертриглицеридемии. Причем тяжесть атеросклероза зависит от длительности заболевания и кумулятивной дозы глюкокортикоидов.
Поражение легких
Можно выделить следующие клинические варианты: плеврит, волчаночный пневмонит, хронический диффузный интерстициальный фиброз легких, легочная гипертензия, эмболия сосудов легких и легочное кровотечение.
Плеврит встречается значительно чаще, чем все остальные легочные проявления СКВ. Больные предъявляют жалобы на сильную, острую, постоянную боль в грудной клетке, усиливающуюся при дыхании, одышку, сухой кашель. При наличии жалоб на рентгенограммах легких удается обнаружить жидкость в плевральной полости. В ряде случаев при наличии подобных жалоб могут выявляться очаги уплотнения легочной ткани, что свидетельствует о развитии либо пневмонии, либо альвеолита, причиной которого является легочный васкулит. В последнем случае возрастает риск развития вторичной инфекции в легких в виде пневмонии, абсцесса легких или эмпиемы плевры.
Хронический диффузный интерстициальный фиброз легких - относительно редкий для СКВ вариант поражения легких. Следует исключать другие причины, которые могли привести к его развитию. Если у больных с СКВ формируется легочная гипертензия, то она плохо поддается коррекции и, как правило, прогрессирует, приводя к смерти. Антифосфолипидный синдром может быть причиной тромбоэмболии ветвей легочной артерии. Высокий риск тромбоэмболии наблюдается при снижении содержания протеина S (собственный антикоагулянт) и длительном пребывании в постели. При полиорганной недостаточности может развиваться легочное кровотечение.
Поражение желудочно-кишечного тракта
К специфическим поражениям желудочно-кишечного тракта можно отнести асептический перитонит, васкулит мезентериальных сосудов, панкреатит, аутоиммунный гепатит. Возможно развитие токсического лекарственного гепатита на фоне приема аспирина, других нестероидных противовоспалительных препаратов, гидроксихлорохина, азатиоприна и др Несмотря на то что аутоиммунный гепатит называют «люпоидным», он встречается у больных СКВ не чаще, чем в общей популяции. Прогрессирование аутоим-муного гепатита в цирроз наблюдается крайне редко.
Поражение почек по типу гломерулонефрита наблюдается у 25-50% больных в дебюте заболевания, а в целом встречается в 60% случаев. В его генезе лежит иммунокомплексныи механизм, характеризующийся отложением на базальной мембране почек иммунных депозитов, содержащих антитела к ДНК. Наличие антител к ДНК в сыворотке крови и гипокомплементемия могут являться предвестником клинических проявлений почечной патологии. Вместе с тем известен ряд факторов риска прогрессирования волчаночного нефрита, которые можно разделить на две группы: модифицируемые и немодифицируемые
Факторы, ассоциируемые с повышенным риском хронической болезнью почек у больных СКВ
|
Немодифицируемые |
Модифицируемые |
|
Мужской пол |
Применение преднизолона в виде монотерапии при пролиферативных формах гломерулонефрита |
|
Негроидная раса |
Уровень креатинина >1,2-2,0 мг/дл |
|
Возрас < 24 лет |
Нефротический синдром |
|
Количество полулуний в биоптате > 50% |
Артериальная гипертензия |
|
Индекс хронизации >1 |
Гематокрит <20% |
|
Низкая приверженность к лечению пациента |
Волчаночный нефрит часто протекает бессимптомно, формируется лишь изолированный мочевой синдром (умеренная протеинурия, цилиндрурия, эритроцитурия, лейкоцитурия). В таких случаях требуется постоянный контроль анализов крови (клиренс креатинина) и мочи (суточная потеря белка, селективность протеинурии).
При прогрессировании заболевания может развиваться нефротический синдром, который представляет собой симптомокомплекс, сочетающий гиперпротеинурию (как правило, суточная потеря белка составляет более 3 г/сут), гипопротеинемию, гиперхолестеринемию и отечный синдром. Нефротический синдром требует проведения дополнительной терапии, направленной на коррекцию белкового и липидного обменов. В клинической картине волчаночного нефрита может преобладать артериальная гипертензия.
Для прогнозирования течения волчаночного нефрита также требуется выяснение его морфологического варианта. В настоящее время принята классификация ВОЗ гломерулонефрита при СКВ, которая основывается на данных световой, электронной микроскопии и иммунофлюоресцентном исследовании биоптатов почек.
Мезангиальный вариант гломерулонефрита обычно протекает относительно благоприятно, ХПН формируется через 7 и более лет, не требует цитостатической терапии.
При диффузном мембранозно-пролиферативном гломерулонефрите на первый план выходят такие проявления нефритического синдрома, как распространенный отечный синдром, артериальная гипертензия, эритроцитурия, что в дальнейшем приводит к развитию почечной недостаточности.
Нефротический синдром при отсутствии артериальной гипертензии, выраженных изменений в мочевом осадке и гипокомплементемии, как правило, обусловлен наличием мембранозного нефрита. При быстро прогрессирующем варианте гломерулонефрита без лечения больные погибают в течение 6-12 месяцев от начала первых клинических проявлений СКВ.
Морфологические типы (или классы) волчаночного гломерулонефрита
(классификация ВОЗ)
|
Типы |
Характеристика |
Типичные клинико-лабораторные проявления |
|
1 тип - нормальные клубочки |
Отсутствие изменений в клубочках при световой микроскопии |
отсутствуют |
|
II тип - мезангиальный нефрит |
II А Отсутствие изменений по данным световой микроскопии,но отложение иммунных комплексов в мезангиуме по данным иммунофлюоресцентной и электронной микроскопии II Б Иммунные депозиты в мезангиуме в сочетании с пролиферацией мезангиума и/или склеротическими изменениями по данным световой микроскопии |
отсутствуют протеинурия <1г/сут,эритроциты 5-15 в поле зрения |
|
III тип - очаговый пролиферативный гломерулонефрит |
Повреждения клубочков в виде некроза и/или склерозирования |
протеинурия <2 г/сут,эритроциты 5-15 в поле зрения |
|
IV тип - диффузный пролиферативный гломерулонефрит |
Без сегментарных поражений Повреждения в виде некрозов Повреждения в виде склерозирования |
протеинурия >2 г/сут,эритроциты >20 в поле зрения,артериальная гипертензия |
|
V тип - диффузный мембранозный гломерулонефрит |
Мембранозный гломерулонефрит Ассоциированный с мезангиальным Ассоциированный с фокально сегментарным или пролиферативным гломерулонефритом Ассоциированный с диффузным гломерулонефритом |
протеинурия >3,5 г/сут,гематурия отсутствует |
|
VI -хронический гломерулосклероз |
Хронический склероз без признаков воспаления и иммунных депозитов |
артериальная гипертензия;почечная недостаточность |
Развитие волчаночного нефрита является плохим прогностическим признаком заболевания. Так, 5-летняя выживаемость при поражении почек составляет 85%, а 10-летняя - 65%.
Поражение центральной нервной системы
Заболевание может сопровождаться нейропсихическими нарушениями примерно в 50% случаев, которые включают как острые, так и хронические расстройства и характеризуются общемозговой и очаговой симптоматикой. Нарушения ЦНС при СКВ настолько разнообразны, что охватывают едва ли не полный спектр неврологических расстройств(упорные головные боли, приступы мигрени, нарушение сна, астения, прогрессирующее снижение памяти, психоэмоциональная неустойчивость). В некоторых случаях заболевание может дебютировать типичными эпилептическими припадками с потерей сознания, прикусыванием языка и судорогами. Судорожные приступы осложняют течение СКВ примерно в 25% случаев. Генерализованные расстройства ЦНС проявляются органическими мозговыми синдромами, психозами (в том числе шизофреноподобными нарушениями) и мозговой комой. Следует иметь в виду, что летальность при этих осложнениях СКВ сравнима с таковой при поражении почек.
Для СКВ характерна мигрень. Приступы головных болей разнообразны по выраженности, продолжительности, частоте возникновения.
Гематологические изменения
Анемия хронического воспаления - наиболее часто встречающееся гематологическое осложнение при обострении СКВ. Генез анемического синдрома при СКВ сложный. Во-первых, нарушается продукция эритроцитов в костном мозге вследствие системного воспалительного процесса. Во-вторых, снижается выработка эритропоэтина почками. Также необходимо учитывать миелосупрессивный эффект, вызванный применением цитостатических препаратов (циклофосфана и азатиоприна). Гемолитическая анемия с положительной пробой Кумбса и ретикулоцитозом является характерным проявлением СКВ, но диагностируется примерно в 10% случаев.
Аутоиммунная тромбоцитопеническая пурпура является одним из проявлений СКВ и может наблюдаться на любой стадии заболевания. Тромбо-цитопения также может быть одним из проявлений антифосфолипидного синдрома.
Лейкопения с лимфопенией - один их лабораторных признаков СКВ, причем, если лейкопения не обусловлена побочным действием цитостатических препаратов, то риск вторичных инфекционных осложнений не велик.
У больных СКВ выявляются нарушения костномозгового кроветворения, проявляющиеся снижением содержания полихроматофильных нормоцитов и увеличением содержания моноцитов и плазматических клеток в миелограмме.
Вторичный антифосфолипидный синдром
Этот синдром определяется предрасположенностью к тромботическим осложнениям и наличием антител против отрицательно заряженных фосфолипидов, таких как волчаночный антикоагулянт и антикардиолипиновые антитела. Антитела к фосфолипидам при СКВ обнаруживаются примерно у каждого второго пациента. Наиболее часто антифосфолипидный синдром наблюдается у пациентов с высоким титром IgG антикардиолипиновых антител или волчаночного антикоагулянта. Однако титр антител может значительно колебаться на протяжении болезни. Клиническими проявлениями АФС являются повторные артериальные и венозные тромбозы, тромбоцитопения и самопроизвольные выкидыши. Наличие хотя бы одного доказанного эпизода артериального или венозного тромбоза требует назначения непрямых антикоагулянтов.
Значительные успехи в лечении волчаночного нефрита достигнуты за последние два десятилетия благодаря разработке комплексных терапевтических схем, включающих в основном две группы препаратов - кортикостероиды и цитостатики общего и селективного действия. Иногда в комплексном лечении тяжелых форм BH используют антикоагулянты. Аминохинолиновые препараты для подавления активности BH неэффективны, их назначают лишь при периферических формах СКВ. Нестероидные противовоспалительные препараты, сохраняющие свою актуальность при экстраренальных проявлениях болезни, при BH не используются из-за их способности снижать клубочковую фильтрацию. Среди экстракорпоральных методов лечения актуальным остается плазмаферез.
Тяжелые побочные реакции современных иммуносупрессоров, а также непредсказуемость течения заболевания, с меняющейся клинической картиной и трансформацией морфологических данных, заставляют продолжать обсуждение и поиск наиболее рациональных подходов к лечению и профилактике обострения BH.
Глюкокортикоиды (ГК) остаются основой лечения BH, существенно улучшая прогноз болезни. При активном нефрите ГК должны применяться в адекватных дозах - 1 мг/(кг*сут) в течение 6-8 нед, после чего дозу можно медленно уменьшать. Доказано преимущество больших доз преднизолона (50-60 мг/сут) перед малыми (30 мг/сут), малые дозы могут подавлять лихорадку, кожные поражения, суставной синдром, серозиты, иногда даже пневмониты и эндокардит, но мало влияют на почечный процесс. При длительном применении больших доз преднизолона эффект отмечается у 50- 80 % больных.
Трудность проведения массивной кортикостероидной терапии определяется необходимостью балансирования между стремлением подавить активность нефрита и страхом перед многочисленными побочными явлениями, особенно часто выявляющимися в последнее время асептическими некрозами костей, тяжелыми спондилопатиями, инвалидизирующими больных. Несколько уменьшило развитие этих осложнений введение разнообразных схем лечения кортикостероидами - разовый прием всей дозы утром либо альтернирующая терапия - прием двойной суточной дозы через день.
Внутривенное введение ударных доз метил-преднизолона или преднизолона (пульс-терапия ГК) привлекает более быстрым достижением эффекта у больных с высокой активностью болезни. Кроме этого, курсы внутривенной пульс-терапии ГК влекут за собой изменение пероральной дозы ГК, что позволяет уменьшить длительность их применения в высоких дозах и тем самым снизить риск развития побочных реакций. При наличии нефротического синдрома и тем более при быстром падении функции почек оправдано проведение пульс-терапии в начале заболевания.
Полагают, что ударные дозы глюкокортикоидов при волчаночном нефрите приостанавливают образование ИК и вызывают изменение их массы путем вмешательства в синтез антител к ДНК, что в свою очередь ведет к перераспределению отложения ИК и выходу их из субэндотелиальных слоев базальной мембраны. Кроме того, ударные дозы метилпреднизолона изменяют проницаемость базальной мембраны, увеличивают скорость клубочковой фильтрации и улучшают кровообращение в почках. Оценка отдаленных результатов подтверждает эффективность пульс-терапии. Так, в наблюдениях С. Ponticelli и соавт. среди 43 больных с волчаночным диффузно-пролиферативным нефритом (у 17 содержание креатинина в сыворотке крови превышало 140 мкмоль/л, у 26 - протеинурия превышала 3 г/сут), которым проводилась трехдневная пульс-терапия метилпреднизолоном с последующей терапией малыми дозами кортикостероидов в сочетании с цитостатиками, 10-летняя выживаемость составила 87 %, а если исключить случаи смерти не от почечной недостаточности, то - 91 %. К концу наблюдения у 21 больного исчезли признаки патологии почек. У больных с хорошим эффектом от лечения уровень креатинина нормализовался через 22 нед после пульс-терапии, протеинурия снизилась до минимальных значений через 55 нед.
По данным Института ревматологии РАМН, применение пульс-терапии метилпреднизоло-ном у 120 больных с активным BH привело к положительному результату в ближайший период в 87 % случаев; анализ отдаленных результатов показал, что через 18-60 мес у 70 % сохранялась ремиссия, причем у 28 % из них полностью исчезли признаки нефрита.
После проведения пульс-терапии для достижения стойкого эффекта необходимо продолжать прием кортикостероидов внутрь. Вместе с тем длительное применение ГК приводит к развитию тяжелых, иногда угрожающих жизни осложнений. Кроме того, в экспериментальных моделях и при повторных биопсиях было доказано, что длительная терапия ГК в больших дозах может приводить к прогрессирующему гломерулосклерозу.
Цитостатики - вторая группа препаратов, представляющая собой патогенетически обоснованную терапию. В основном применяют алкилирующие агенты - циклофосфамид (ЦФА), реже хлорбутин, и антиметаболиты: азатиоприн (АЗА) и метотрексат. В последнее время применяется селективный иммуносупрессор сан-диммун-неорал.
Среди цитостатиков преимущество отдают циклофосфамиду (ЦФА) перорально или в виде внутривенной пульс-терапии. Впервые внутривенно пульс-терапия ЦФА была предложена Н. Dinant и соавт. в 1982 г. именно для лечения BH. К концу 80-х годов в ряде клинических исследований было показано, что пульс-терапия ЦФА эффективнее предотвращает снижение функции почек по сравнению с пульс-терапией метил пред низо лоном с последующим 6-месячным пероральным приемом ГК. Ежеквартальное проведение пульс-терапии ЦФА уменьшало вероятность обострения болезни. Эти данные подтвердил анализ более 400 клинических исследований), проведенный V.K.Bansal и соавт.
Лечебная тактика при BH зависит от активности болезни, клинического и морфологического варианта BH. Проведение биопсии почки необходимо для характеристики морфологических изменений с целью выбора адекватной терапии, а также для оценки прогноза заболевания (индексы активности и склероза). Активность проводимой терапии должна соответствовать активности болезни: чем выше активность процесса и тяжелее клинические и морфологические признаки болезни, тем раньше следует назначать весь арсенал терапии, особенно пульс-терапию ЦФА. Иногда при сопутствующей высокой артериальной гипертензии врачи воздерживаются от активного лечения. Однако в большинстве случаев АГ является отражением активности процесса и исчезает при ремиссии заболевания.
Быстропрогрессирующему волчаночному нефриту морфологически чаще всего соответствует диффузный пролиферативный BH (IV класс). Прогноз больных БПВН тяжелый и зависит от своевременной максимально активной терапии. Методом выбора при БПВН является, по нашему мнению, пульс-терапия ЦФА (в дозе 15-20 мг/кг с поправкой на уровень сывороточного креатинина и скорость клубочковой фильтрации: при креатинине >> 4 мг% и КФ < 50 мл/ мин дозу снижают в 2 раза) с интервалом 3- 4 нед в сочетании с терапией КС. Пульс-терапия ЦФА должна проводиться непрерывно не менее б мес (один пульс в месяц), а в дальнейшем ее длительность определяется динамикой клинико-лабораторных показателей: при полном восстановлении функции почек и минимальной активности мочевого синдрома (отсутствии гематурии) возможно уменьшение дозы ЦФА и удлинение интервалов проведения пульсов (через 2, затем через 3 мес) с последующей полной отменой. Первый «пульс» ЦФА желательно сочетать с пульсами метилпредни-золона (по 1 г в течение 3 дней) одновременно с назначением преднизолона внутрь в дозе 1 мг/кг в сутки. Можно повторять пульсы метипреда в ситуациях, когда возникает необходимость быстрого снижения пероральной дозы ГК в связи с осложнениями, а активность процесса остается высокой. После внутривенного введения метипреда дозу перорального преднизолона можно значительно снизить. Продолжать прием преднизолона внутрь в суточной дозе 1 мг/кг в сутки следует в течение 6-8 нед с постепенным ее снижением к 6-му месяцу до 20-30 мг/сут и в последующие 6 мес до поддерживающей дозы 5-10 мг/сут, которую следует принимать в течение 2-3 лет, а иногда 5 лет и пожизненно. Обычно при таком терапевтическом режиме БПВН клинико-лабораторной ремиссии можно достичь через 1,5-2 года.
Нами проанализированы результаты лечения 38 больных с БПВН. В первой группе (27 больных) применялись большие дозы преднизолона внутрь - 50-60 мг/кг, в части случаев в сочетании с цитостатиками внутрь (чаще всего азатиоприном в дозе 150-200 мг/сут). Больные второй группы (11 больных) наряду с высокими дозами ГК внутрь получали пульс-терапию ГК и пульс-терапию ЦФА. У больных первой группы «почечная» выживаемость в течение первого года составила менее 30 % и через 5 лет - 5 %. Во второй группе через год и через 5 лет почечная выживаемость равнялась 75 %. Важным прогностическим фактором для результатов терапии был непосредственный эффект лечения. В случаях быстрого адекватного ответа у больных второй группы 5-летняя почечная выживаемость составила 100 %.
При бурном прогрессировании почечной недостаточности возможно проведение плазмафереза (3 раза в неделю в течение 1-3 нед или один раз в 2-3 нед, всего 6-8 процедур) желательно с заменой объема свежезамороженной плазмой.
Плазмаферез используют для удаления циркулирующих иммунореактантов, но единого мнения о целесорбразности его применения при BH нет. Так, H.Y. Euler и соавт. с успехом применили у 14 больных так называемую синхронную терапию: 3 сеанса плазмафереза с последующим проведением 3 сеансов пульс-терапии ЦФА в дозе 12 мг/кг и затем пероральным приемом в течение 6 мес. Цель такой методики - подавление циркулирующего пула лимфоцитов в период их максимальной компенсаторной активации, спровоцированной плазмаферезом.
E.J. Levis и соавт. в контролируемом рандомизированном исследовании влияния плазмафереза в сочетании с глюкокортикоидной терапией и цитостатической терапией на течение BH, проведенном в 14 центрах (89 больных), не выявили преимуществ этого лечения по сравнению с той же схемой, но без применения плазмафереза.
При необходимости иммуносупрессивную терапию целесообразно проводить на фоне сеансов гемодиализа. При клинических и лабораторных признаках ДВС-синдрома показаны переливания свежезамороженной плазмы в сочетании с антиагрегантами, антикоагулянтами и ангиопротекторами. Необходима коррекция артериальной гипертензии с обязательным использованием в схеме ингибиторов АПФ.
Однако не все исследователи считают, что внутривенная пульс-терапия ЦФА имеет преимущество по сравнению с его пероральным приемом.
С. Ponticelli рекомендует начинать лечение с трех внутривенных введений метил-преднизолона (по 0,5 г каждый) с последующим назначением преднизолона внутрь в дозе 0,5-1 г/кг в сутки длительностью 1-2 мес; постепенно дозу уменьшают до 10 мг ежедневно или 20 мг через день. При особо тяжелом течении болезни с самого начала добавляют цитостатики - вначале ЦФА (1,5-2 мг/кг) в течение 2-3 мес, а затем азатиоприн (1,5-2 мг/кг в сутки), который считается менее эффективным, чем циклофосфамид, но и менее токсичным, что позволяет применять его продолжительно - до 2 лет. Лечение прекращают постепенно при нормальном уровне сывороточного креатинина, снижении протеинурии ниже 1 г/с и отсутствии других признаков болезни. У находившихся под наблюдением 56 больных с диффузным пролиферативным BH, получивших подобную терапию, 10-летняя выживаемость составила 98 % и 20-летняя - 77 %. К концу наблюдения у 24 была отмечена ремиссия, у 18 - нормальная функция почек и симптоматическая протеинурия, у 2 больных - нефротический синдром при сохранной функции почек, у 6 - сывороточный креатинин был 1,6- 3 мг/дл, 6 больных получали программный диализ.
Близкой схемы придерживается и J.S. Cameron.
V. К.Banzal и соавт. сравнили частоту развития ХПН и летальность у 440 больных, наблюдавшихся в 19 нефрологических центрах в период за 1970-1995 гг. и получавших одну из схем терапии: 1) только преднизолон внутрь; 2) азатиоприн и преднизолон внутрь; 3) азатиоприн и циклофосфамид с преднизолоном внутрь; 4) преднизолон внутрь и циклофосфамид внутривенно. Вероятность развития ХПН и летальность были ниже у больных, получавших сочетание цитостатиков и ГК. He было выявлено преимущества азатиоприна перед цикло-фосфамидом, а также внутривенной пульс-терапии ЦФА перед его пероральным приемом, но побочных реакций при в/в пульс-терапии ЦФА было значительно меньше.
Медленно прогрессирующий вариант BH с нефротическим или выраженным мочевым синдромом может иметь в основе любой морфологический вариант. Подходы к лечению при диффузном или очаговом волчаночном нефрите (BH) и мезангиокапиллярном гломерулонефрите (МКГН) должны быть почти такими же активными, как и при БПВН, поскольку при неадекватной терапии болезнь может прогрессировать в почечную недостаточность. При других морфологических вариантах (мембранозном и мезангиопролиферативном) иммуносупрессивный режим может быть более мягким: сочетанная пульс-терапия в начале лечения с последующим применением ПЗ в дозе 0,5 мг/кг в сутки в сочетании с пульс-терапией ЦФА или преднизолон 50-60 мг/сут + ЦФА 100-150 мг/сут внутрь в течение 2-3 мес; затем суточные дозы ПЗ снижают до 20-30 мг, ЦФА - до 100- 50 мг или заменяют его азатиоприном в такой же дозе и проводят лечение до достижения ремиссии.
При отсутствии морфологического подтверждения показанием к активной терапии служит нефротический синдром, выраженная эритро-цитурия, артериальная гипертензия, признаки снижения функции почек. При изолированной протеинурии с незначительной эритроцитурией возможно менее активное лечение (преднизолон в дозе 50-60 мг/сут), однако при устойчиво сохраняющемся более 8 нед мочевом синдроме к лечению следует присоединить цитостатики.
Еще раз подчеркнем, что снижение дозы ГК и цитостатиков должно проводиться очень медленно (значительно медленнее, чем при брайтовом нефрите), и в любом случае необходима длительная поддерживающая терапия. Показанием к отмене иммуносупрессивной терапии независимо от клинической и морфологической формы болезни является отсутствие признаков активности нефрита (протеинурия не более 0,5 г/сут без эритроцитурии) и серологических признаков активности болезни.
Селективный иммуносупрессор сандиммуннеорал (циклоспорин - ЦсА) при BH пока не получил такого широкого распространения, как при брайтовом нефрите.
Е.C. Bergijk и соавт. в экспериментальной мышиной модели BH интраперитонеально вводили ЦсА в дозе 10, 50, 100 и 250 мг/кг в неделю через 2, 4 и б нед после индукции болезни. Инъекции в дозе 10 или 50 мг/кг в неделю не влияли на развитие нефрита, в дозе 100 мг/кг в неделю предотвращали появление протеинурии при начале лечения через 2 нед после индукции болезни. В группе больных с началом лечения через б нед после индукции заболевания ЦсА был эффективен только в дозе 250 мг/кг в неделю у мышей с небольшой протеинурией.
P.D. Yin и X.Y. Yang у 30 больных с активным BH сравнивали эффективность ЦсА и внутривенной пульс-терапии ЦФА в двух группах по 15 больных. Снижение активности болезни и уровня протеинурии, повышение сывороточного альбумина у леченных ЦсА наблюдали на более ранних этапах, хотя общий эффект был одинаковым. Очевидно, использование низких доз ЦсА гасило активность BH на ранних стадиях терапии, что позволило снизить дозу КС и ЦФА и уменьшить побочные эффекты. У 8 больных после отмены ЦсА был добавлен ЦФА для предупреждения обострения болезни.
С. Dostal и соавт. в неконтролируемом предварительном исследовании, включавшем 11 больных с активным BH с нефротическим синдромом, у 8 из которых предшествующая терапия циклофосфамидом, азатиоприном и глюкокортикоидами была малоэффективна, проводили лечение ЦсА в начальной дозе 3,5-5,5 мг/кг в сутки. Отмечался быстрый эффект: протеинурия снижалась с 9,1 до 1,7 г/сут, при повторных биопсиях отмечено снижение класса морфологических изменений с IV на III. В дальнейшем больные получали поддерживающую дозу 2,5-3 мг/кг в сутки.
По клиническому эффекту ЦсА превосходит глюкокортикоиды, однако его применение ограничивается нефротоксическим действием. J. Radhakrishnan и соавт. у 5 больных с плохим ответом на иммуносупрессивную терапию применяли ЦсА в дозе 4-6 мг/кг в сутки в течение длительного времени - до 43 мес. Наряду с клиническим улучшением при повторных биопсиях отмечалось уменьшение признаков активности, однако индекс склероза увеличился.
ЦсА, очевидно, может быть использован при медленно прогрессирующих формах, протекающих без тяжелой артериальной гипертензии и без выраженного склероза почечной ткани.
С учетом отдельных сообщений складывалось впечатление об улучшении течения BH при внутривенном введении иммуноглобулинов, хотя в контролируемом исследовании его эффективность была подвергнута сомнениям. Имеются единичные наблюдения эффективного применения микофенолат-мофетила.
Разрабатываются средства, селективно влияющие на отдельные этапы патогенеза СКВ. Есть первые экспериментальные и клинические опыты применения LJP394, селективно воздействующего на синтез антител к нативной ДНК В-лимфоцитами, ингибитора С5 фракции комплемента «Alexion», простагландина 1, антагонистов рецепторов тромбоксана.
При развитии терминальной почечной недостаточности проводится заместительная терапия - гемодиализ и трансплантация почек. По данным отчета USRDS (United States Renal Data System), в 1992-1996 гг. в США заместительную почечную терапию получали 4177 больных BH (из них 80,6 % - женщины и 19,4 % - мужчины).
В нашем центре гемодиализ проводили 32 больным BH с терминальной почечной недостаточностью. По данным ряда исследователей, результаты гемодиализа были такими же, как при других заболеваниях почек, однако в наших наблюдениях больные BH переносили гемодиализ хуже, чем больные без системных заболеваний.
Особенностью терминальной стадии BH в отличие от брайтова нефрита является иногда сохраняющаяся высокая активность процесса: если активность СКВ остается к моменту развития нефросклероза, необходима иммуносупрессивная терапия на фоне сеансов гемодиализа.
Трансплантацию почек производят больным с развернутой клиникой уремии обязательно при отсутствии признаков активности СКВ, поэтому страх перед обострением СКВ с рецидивом BH в трансплантате, по мнению большинства авторов, следует считать необоснованным, хотя в сообщении G. Nyberg и соавт. отмечена высокая частота (у 7 из 16 больных) рецидива BH в трансплантате.
J. Briggs и E. Jones от имени Научного комитета ERA-EDTA представили в 1999 г. обобщенные результаты трансплантации почек у больных СКВ в Европе за 1982-1990 гг. Авторы установили, что в целом результаты были такими же, как у больных первичными заболеваниями почек (стандартная группа больных). За эти годы трансплантация была проведена 539 больным СКВ; средний возраст больных составлял 33 года, преобладали (79 %) женщины. Выживаемость трансплантата (трупного) была лишь немного ниже, чем в стандартной группе (5-летняя выживаемость составила соответственно 65 и 68 %, 10-летняя - 45 и 50 %); выживаемость больных была практически одинаковой: 5-летняя - 91 % в обеих группах, 10-летняя - 81 и 83 % соответственно. Трехлетняя выживаемость трансплантатов от живых доноров при СКВ была даже выше (87 %), чем в стандартной группе (79 %). Среди причин смерти у больных СКВ инфекции встречались чаще по сравнению со стандартной группой (40 и 26%), тогда как сердечно-сосудистые осложнения - реже. Случаев потери трансплантата из-за рецидива BH не отмечено.
